(Ciencias de Joseleg) (Biología) (Teoría
de la Biología) (Genética clásica) (Ejercicios
resueltos) (1-Introducción)
(2-Genética
premendeliana) (3-Gregor
Mendel) (4-Probabilidad
y estadística) (5-Diseño
experimental mendeliano) (6-Resultados
del cruce monohíbrido) (7-Ley
de la segregación independiente) (8-El
cuadro de Punnett) (9-Como
resolver el cruce monohíbrido) (10-Comparando
experimento vs teoría) (11-Ley
de la distribución independiente) (12-Resolviendo
dihíbridos y trihíbridos) (13-Los
microscopistas) (14-Los
mendelianos 1) (15-Los
mendelianos 2) (16-Teoría
cromosómica de la gerencia) (17-El
señor de las moscas) (18-Mendelismo
no mendeliano) (19-Polimorfismo
genético) (20-Dominancia
incompleta) (21-Codominancia)
(22-Letalidad
genética) (23-Ligamiento
al sexo) (24-Las
epistasis) (25-Penetrancia,
expresividad y pleiotropía) (24-Análisis
de pedigrí) (ref-Referencias
bibliográficas)
En humanos y muchas otras especies de animales, el sexo está
determinado por cromosomas específicos. Pero ¿cómo descubrieron los
investigadores estos llamados cromosomas sexuales? Los cromosomas que llevan
esos genes relacionados con las características sexuales tienen una larga e
intrigante historia de exploración. Como sucede a menudo durante un curso tan largo
de descubrimiento, los científicos notaron la aparición de estos cromosomas
antes de saber exactamente qué eran estas estructuras.
Los cromosomas sexuales
El primer indicio
de que los cromosomas sexuales eran diferentes de todos los demás cromosomas restantes
provino de los experimentos realizados por el biólogo alemán Hermann Henking en
1891. En este momento, los científicos podrían ver fácilmente la división de
células mitóticas mediante microscopía óptica. De hecho, mientras usaba este
método para estudiar la formación de esperma en avispas, Henking observó que
algunas células de esperma de avispa tenían 12 cromosomas, mientras que otras
solo tenían 11. Además, mientras observaba las etapas de la meiosis que
formaban estas células espermáticas, Henking notó que el cromosoma 12 extra se
veía diferente de todos los demás. Así llamó a este cromosoma el "elemento
X" para representar su naturaleza desconocida. Curiosamente, en estudios
posteriores sobre la formación de huevos de saltamontes hembra, Henking no pudo
detectar el elemento X (Brown, 2003;
Pierce, 2005). Sobre la base de estas observaciones,
Henking hipotetizó que este cromosoma adicional debía desempeñar un papel en la
determinación del sexo en los insectos. Sin embargo, no pudo reunir ninguna
evidencia directa que respaldara esta hipótesis.
Aproximadamente 10 años después de los estudios de Henking,
el zoólogo estadounidense C. E. McClung comenzó una extensa investigación sobre
la idea de que el elemento X debe tener algo que ver con la determinación del
sexo. En primer lugar, McClung afirmó que este extraño cromosoma se denominaría
"cromosoma accesorio" porque parecía tener un propósito diferente en
comparación con los otros cromosomas. Luego, decidió emprender un amplio
estudio comparativo de la espermatogénesis, no solo en insectos, sino en muchos
organismos diferentes, incluidas las arañas y los ratones. Mientras observaba
la generación de esperma en los saltamontes, McClung observó que el cromosoma
accesorio no se comportaba como los otros cromosomas durante la primera
división meiótica. Específicamente, este "duodécimo cromosoma" no se
distribuyó por igual a las cuatro células espermáticas que surgieron de un
espermatogonio de saltamontes; en cambio, estaba presente solo en la mitad de
ellos. Este patrón constante de segregación en la espermatogénesis de muchos
organismos diferentes hizo que McClung especule que debe haber alguna razón
fundamental para la generación de dos tipos de células de esperma.
McClung pensó en las consecuencias de esta distribución 50/50
del cromosoma accesorio, consecuencias de las cuales Darwin ya había hablado a
Wallace debían ser de tipo categórico a Wallace, y se preguntó cómo esta
distribución probablemente resultó en dos tipos diferentes de cigotos. También
observó que, en realidad, solo había una característica que variaba entre zigotos
de muchas especies diferentes en proporciones de 50/50, y esa característica
era el sexo. Por lo tanto, cuando reunió todas las pruebas, McClung propuso que
el cromosoma accesorio debe influir en la determinación del sexo en un cigoto (Brown, 2003). McClung estaba tan ansioso
por comunicar formalmente su hipótesis de que escribió una vista previa de esta
idea (McClung, 1901) que se publicó como una breve
carta aproximadamente un año antes de que su manuscrito completo apareciera en
un diario (McClung, 1902).
La teoría cromosómica de la herencia
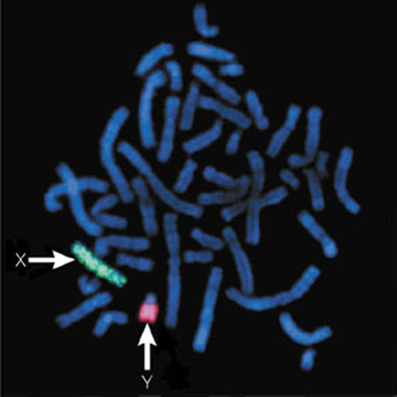
Figura 23‑1. Cromosomas humanos
sexuales. Los cromosomas X e Y están indicados por flechas.
Más o menos por la misma época, Walter Sutton, que fue uno de
los antiguos alumnos de McClung, publicó un artículo independiente que
examinaba completamente los cromosomas en el saltamontes y proporcionaba datos
que apoyaban firmemente la hipótesis de McClung con respecto al cromosoma
accesorio. En su estudio, Sutton siguió de cerca el camino de los cromosomas a
lo largo de la meiosis en células espermáticas, y demostró con dibujos de
etapas meióticas sucesivas que las células espermáticas contenían la mitad del
número total de cromosomas presentes en cigotos de saltamontes. La cuidadosa
consideración de Sutton de cómo el material cromático segregado en células
espermáticas se convirtió en el punto de partida para la teoría
cromosómica de la herencia. Para
desarrollar esta teoría, Sutton contó cada cromosoma presente en células de
esperma de saltamontes y midió su tamaño. Luego clasificó cada cromosoma según
estas medidas de tamaño. La observación cuidadosa de Sutton del número de
cromosomas y la segregación lo llevaron a concluir que los gametos llevan la
mitad de la colección cromosómica total en un cigoto; también determinó que la
fusión de dos gametos durante la fertilización debe ser el mecanismo por el
cual los pares de cromosomas se reforman (Miko, 2008c). A lo largo de las numerosas observaciones que
condujeron a esta conclusión, Sutton tomó nota
cuidadosamente
del camino del cromosoma accesorio. Con base en estas observaciones, afirmó
que, aunque era diferente en su segregación en células de esperma, el cromosoma
accesorio era de hecho un verdadero cromosoma (Sutton, 1902).
La idea de que el sexo podía ser determinado por los
cromosomas era una idea nueva. Antes de los informes de Henking, McClung y
Sutton, la determinación del sexo se atribuía a factores distintos de los
gametos, como el entorno en el que existían las células de huevo, idea que
venía desde tiempos de Aristóteles. Por lo tanto, el tema del cromosoma
accesorio fue un animado tema de debate a principios del siglo XX. La
controversia pronto comenzó a desvanecerse, sin embargo, ya que varios otros
científicos informaron casos similares de cromosomas "no
coincidentes" en otros organismos. Por ejemplo, al examinar las
diferencias entre los escarabajos machos y hembras, la investigadora
estadounidense Nettie Stevens reconoció patrones de cromosomas que diferían
entre los dos sexos. En particular, encontró un par de cromosomas
desequilibrados en las células masculinas, y llamó a estas estructuras
"heterocromosomas" (Miko, 2008c).
De manera similar, el genetista estadounidense E. B. Wilson
trabajó con varias especies de insectos diferentes y observó que, aunque había
un número igual de cromosomas en las células masculinas y femeninas, un par en
los machos era diferente en tamaño. Llamó a estos pares no coincidentes
"idiocromosomas", tal vez porque eran idiosincrásicos (Wilson, 1905). Wilson se convenció de que
el más grande de los dos era en realidad el "cromosoma accesorio" y
que su cromosoma asociado más pequeño y arrugado no había sido detectado por
Henking, McClung y Sutton. Por lo tanto, de acuerdo con Wilson, aunque el
cromosoma accesorio sí tenía algo que ver con la determinación del sexo, no era
un cromosoma solitario, no apareado; en la mayoría de los casos, tenía una
pareja.
Después del descubrimiento de Wilson, surgió cierta
confusión acerca de cómo llamar a estas aparentes diferencias en la
clasificación cromosómica observada en cada sexo. Parte de esta confusión se
relacionaba con el hecho de que numerosas especies estaban siendo examinadas, y
estas especies variaban en términos de número cromosómico y disposición. Por lo
tanto, persistieron los desafíos para el desarrollo de una teoría unificadora
sobre cómo los cromosomas realmente determinan el sexo de un organismo (Miko, 2008c).
Diferentes
seres vivos determinan su sexo de manera diferente
Una pregunta
principal que enfrentaban los científicos de la época era si la masculinidad
estaba asociada con la ausencia o la presencia del cromosoma deformado. Una vez
más, E. B. Wilson se propuso encontrar la respuesta. Wilson se interesó
profundamente en el trabajo de su colega Nettie Stevens, y se propuso combinar
sus encuestas de especies de escarabajos múltiples con las suyas. Stevens
(1905) había observado que, en las especies de escarabajos de Tenebrio, había
un par de cromosomas de apariencia inusual que se separaban para formar
diferentes células espermáticas. Con base en las comparaciones de la apariencia
cromosómica en otras células de Tenebrio masculino y femenino, ella propuso que
estos cromosomas accesorios probablemente estaban relacionados con la herencia
del sexo. Wilson observó independientemente patrones similares en una variedad
de insectos. Reforzado por el trabajo de Stevens, Wilson propuso que, entre los
dos "cromosomas sexuales" reconocibles, era posible que uno fuera un
"determinante femenino" y el otro un "determinante
masculino" (Wilson, 1905). Sin embargo, en algunos insectos, incluidas las
avispas, la masculinidad se asoció con la ausencia de un cromosoma adicional.
¿Cómo, entonces, podrían conciliarse las observaciones en escarabajos con las
de las avispas?
En un intento de resolver este dilema, Wilson intentó
organizar los datos recientes de su laboratorio y de otros junto con las
observaciones anteriores de Henking, y comenzó con los recuentos cromosómicos.
Específicamente, Wilson comparó el número de cromosomas en las células somáticas
regulares de cada especie con el número de cromosomas en las células germinales
de estas especies. Con base en sus hallazgos, propuso que existían dos
categorías de patrones de emparejamiento cromosómico, y denotó estas categorías
tipo A y tipo B. Las células somáticas de los machos de tipo A tenían un
cromosoma menos que las células somáticas de las hembras de la misma especie.
En la especie de Tipo B, sin embargo, el número de cromosomas era el mismo en
ambos sexos Tabla 23‑1.
Por lo tanto, el sexo no podría determinarse de forma universal por la cantidad
de cromosomas en las células somáticas regulares de los organismos (Miko, 2008c).
Pero, ¿cómo se relacionan estos recuentos de cromosomas en las
células somáticas con los recuentos en los gametos? Wilson argumentó que la
cantidad de cromosomas en los gametos de un organismo dependía de si el
organismo era de una especie Tipo A “heterogamética” o una especie Tipo B
“homogamética”. Wilson luego definió los dos grupos basándose en cómo sus
cromosomas sexuales se separaron en gametos. Sus descripciones fueron las
siguientes (Miko, 2008c).
Especie
tipo A o heterogamética
En los organismos de estas especies, las células somáticas
masculinas tienen un cromosoma no apareado, el accesorio. Entonces, mientras
que las hembras tienen n cromosomas, los machos siempre tendrán cromosomas n-1.
Además, los gametos femeninos (óvulos) siempre tendrán n / 2 cromosomas,
mientras que los gametos de los machos (espermatozoides) tendrán una mitad
(n-1)/2 y la otra mitad n/2, por lo que el cromosoma accesorio desapareado pasa
solo a la mitad de las células espermáticas, por lo que la mitad tendrá este
cromosoma, mientras que la otra mitad estará sin él. Dado que el hacho produce
dos tipos de gametos con cantidades cromosomales diferentes se los denomina
heterogaméticos (Miko, 2008c).
Especies
de tipo B u homogamética
En los organismos de estas especies, todos los pares de
cromosomas son del mismo tamaño en las células somáticas femeninas, y cada
cromosoma tiene una pareja, como las cantidades cromosomales son homogéneas, se
los denomina homogaméticos. En las células somáticas masculinas, todos los
pares de cromosomas son de igual tamaño excepto por un par: estos son los
"idiocromosomas". De hecho, el miembro más pequeño y de aspecto más
arrugado solo está presente en las células masculinas. Tanto los óvulos como
los espermatozoides de estas especies contienen n / 2 cromosomas. Sin embargo,
en los espermatozoides, los cromosomas de tamaños desiguales se separan en dos
tipos diferentes de gametos masculinos, uno con el idiocromosoma X más grande y
el otro con el idiocromosoma de aspecto más pequeño y arrugado (Miko, 2008c).
Otras
formas de determinación del sexo
Temperatura
La determinación del sexo en los seres vivos es diversa,
algunos dependen de factores físicos como la temperatura en muchas especies de
reptiles, En las cuales los machos se generan cuando el huevo incuba a unos
25°C o menos, mientras que las hembras se generan cuando el huevo incuba entre
26-30°C (Georges & Holleley, 2018; Pezaro, Doody, & Thompson, 2017).
Nivel
de ploidía
Otros lo realizan dependiendo de la cantidad de copias de
todos los cromosomas “ploidía”, de esta forma en las abejas los machos son
haploides (n) mientras que las hembras y la reina son diploides (2n). Este
proceso es denominado poliandría (Bachtrog et al., 2014; Tarpy & Page, 2002).
Sistema
ZZ/ZW
En las aves y otros insectos se presenta el sistema ZZ
(macho)/ ZW (hembra), siendo un proceso inverso al que determina el sexo en los
mamíferos. El ligamiento al sexo es importante ya que muchas enfermedades
genéticas de importancia presentan un claro ligamiento a cromosomas sexuales (Miko, 2008c).
El
tamaño del cromosoma sí importa
El cromosoma X especialmente, se estima que este posee cerca
de 1100 genes en comparación de los aproximadamente 86 genes del cromosoma Y;
de esos 1100 genes aproximadamente el 40% han sido asociados con variantes
relacionadas con fenotipos patológicos. De esta manera vamos a tener dos
patrones de ligamiento en los mamíferos como el ser humano, el (6)ligamiento al
cromosoma X y el ligamiento al cromosoma Y (Klug et al., 2012).
Recesivas
Por lo general las enfermedades genéticas se provocan por
perdidas funcionales de un gen, lo cual genera un alelo letal recesivo, de allí
que los problemas de ligamiento al sexo se involucren principalmente con
herencias recesivas, como es el caso de la hemofilia, que se hereda
precisamente ligada al cromosoma X como un alelo recesivo. En las herencias
recesivas letales debemos tener en cuenta el proceso de compensación de dosis,
en los cuales el heterocigoto aun cuando porta el alelo letal, no manifiesta
síntomas de la enfermedad, pero puede heredarla a sus descendientes,
especialmente a los hemicigotos. Es por esto por lo que estos heterocigotos
también se llamados portadores asintomáticos. En el siguiente cruce tenemos una
madre sana pero portadora de la enfermedad y un padre sano (Miko, 2008c). La cantidad de
mujeres con fenotipo sano es mayor que el de niños ya que las mujeres pueden
tener el genotipo heterocigoto que es portador asintomático, mientras que los
hombres son hemicigóticos.
( 23.1 ) Letalidad recesiva
ligada al cromosoma X humano.
Las hembras sanas portadoras se cuentan como sanas, pero
también como portadoras dependiendo de la pregunta.
Miremos un ejemplo:
DEMOSTRACIÓN: Programar una calculadora en Excel para la
herencia letal recesiva ligada al cromosoma X.
Ejemplo. Una mujer portadora del alelo de la
hemofilia se cruza con un hombre sano. Determina los fenotipos de las crías, y
realice una comparación entre hembras y machos. Usar cuadro de Punnett.
Todas las hembras se
verán sanas (♀), aunque la mitad de ellas será portadora (XAXa). La mitad de los machos serán sanos (♂) y la otra mitad enfermos (♂E). Las mujeres tenderán a transmitir la
enfermedad a sus hijos varones.
La selección en los machos contra los desórdenes del
cromosoma X es severa, es decir, muchos de los niños afectados son incapaces de
llegar a la edad reproductiva y reproducirse. Las niñas portadoras son quienes
mantienen los alelos recesivos-letales en la población debido a que al
manifestar fenotipos normales la selección natural nada puede hacer en su
contra. Un ejemplo es la hemofilia, donde solo el 70% de los descendientes
hemofílicos son capaces de llegar a la edad reproductiva, es decir la aptitud
darwiniana de estos individuos es de w(♂)=0,7. Existen
otras anormalidades tan severas que matan a los niños antes de llegar a la edad
reproductiva casi con un 100% de certeza, y ese es el caso de la distrofia
muscular de Duchenne. Las mutaciones de novo o espontáneas representan
una fracción significativa de los casos aislados para enfermedades ligadas el
cromosoma X. De estas aquellas con dominancia tienden a ser eliminadas de la
población debido a que la selección natural puede eliminar a los individuos
enfermos, pero las que son recesivas ingresarán a la población, y dependiendo
de la deriva genética se quedarán o serán eliminadas.
Dominantes
La herencia dominante ligada al cromosoma X, es un modo de
herencia genética por el cual un gen dominante se transmite en el cromosoma X.
Como patrón de herencia, es menos común que el tipo recesivo vinculado a X. En
medicina, la herencia dominante ligada a X indica que un gen responsable de un
trastorno genético se encuentra en el cromosoma X, y solo una copia del alelo
es suficiente para causar el trastorno cuando se hereda de un padre que tiene
el trastorno. En este caso, alguien que exprese un alelo dominante ligado a X
exhibirá el trastorno y se considerará afectado.
Los rasgos dominantes ligados al X no necesariamente afectan
a los hombres más que a las mujeres (a diferencia de los rasgos recesivos
ligados al X). El patrón exacto de herencia varía, dependiendo de si el padre o
la madre tienen el rasgo
de interés. Todos los padres afectados por un trastorno
dominante ligado a X habrán afectado a las hijas pero no a los hijos afectados.
Sin embargo, si la madre también está afectada, los hijos tendrán la
posibilidad de verse afectados, dependiendo de si se transmite un cromosoma X
dominante o recesivo. Cuando el hijo se ve afectado, la madre siempre se verá
afectada.
Algunos estudiosos han sugerido que se descontinúen los
términos dominante y recesivo al referirse a la herencia ligada al X debido a
los múltiples mecanismos que pueden resultar en la expresión de rasgos ligados
al X en las hembras, que incluyen expresión celular autónoma, inactivación X
sesgada, expansión clonal y mosaicismo somático. Sin embargo, como se mencionó
anteriormente, para los problemas de lápiz y papel asumiremos condiciones
ideales.
La Hipofosfatemia ligada al cromosoma X (XLH) en un ejemplo
de este tipo de herencia, es una forma dominante de raquitismo (u osteomalacia)
ligada al X que difiere de la mayoría de los casos de raquitismo en que la
suplementación con vitamina D no la cura. Puede causar deformidad ósea,
incluyendo estatura baja y genu varum (pierna pálida). Se asocia con una
mutación en la secuencia del gen PHEX (Xp.22) y la inactividad subsiguiente de
la proteína PHEX (Saito et al., 2009). La prevalencia de la enfermedad es 1: 20000 (Carpenter, 1997).
( 23.1 ) Letalidad dominante
ligada al cromosoma X humano.
DEMOSTRACIÓN: Programar una calculadora en Excel para la
herencia letal dominante ligada al cromosoma X.
Ejemplo. Una mujer heterocigota que sufre de
raquitismo hipofosfatémico se cruza con un hombre sano. Determina los fenotipos
de las crías, y realice una comparación entre hembras y machos. Usar cuadro de
Punnett.
Herencia
ligada al cromosoma Y
En este caso dado que nunca se encuentra en presencia de dos
alelos, no hay concepto de dominante o recesivo, y lo que importa es determinar
la presencia o transferencia del alelo marcado como importante y su
correspondiente fenotipo, el cual nuevamente, se estudia para algunas
enfermedades genéticas. Característicamente, si un padre posee un rasgo
heredado por ligamiento a cromosoma y, todos sus hijos varones portaran el
rasgo marcado. Algunos ejemplos son: ASMTY (acetilserotonina metiltransferasa);
TSPY (proteína testicular), IL3RAY (receptor de interleuquina-3); SRY (región
de determinación sexual); TDF (factor de determinación testicular); ZFY
(proteína de dedo de Zn); RKY (quinasa de proteínas ligadas al cromosoma
Y), AMGL (amelogenina), CSF2RY (granulocite-macrofago, factor de recepción de
estimulación de colonización, subunidad alfa), ANT3Y (translocador 3 de
adenina), SOX21 (calvicie); AZF2 (factor 2 de azoospermia); BPY2 (proteína
básica del cromosoma Y); AZF1 (factor 1 de azoospermia), entre otros.
( 23.1 ) Letalidad ligada al
cromosoma y humano.
Ejemplo. Un hombre con deficiencia del receptor de la
interleucina 3 se cruzó con una mujer sana. El alelo está ligado al cromosoma
y, determine las probabilidades de la descendencia en su fenotipo.
Silenciamiento
del cromosoma X
Los casos que vimos anteriormente asumen que los dos
cromosomas X presentan compensación de dosis, sin embargo, ese no es siempre el
caso, al menos en los seres humanos. En los mamíferos como el ser humano uno de
los cromosomas X se silencia, por lo que las probabilidades de expresar un
fenotipo dado en las hembras heterocigotas no será 100% para el dominante, sino
que será una probabilidad del 50% de expresar el dominante o el recesivo, y
esto afecta los procesos de deducción matemática real. Raras veces se expresa
el silenciamiento del cromosoma X en los ejercicios de lápiz y papel básicos.
Los alelos dominantes y recesivos pueden asociarse de manera
preferente al cromosoma X que es activado o desactivado. La inactivación es el
caso en el que el alelo funcional se ubica en el cromosoma que es inactivado de
manera preferente, lo cual incrementa la penetrancia de alelo recesivo en los
heterocigotos. Los efectos varían, por ejemplo, en el síndrome de Hunter la
penetrancia es baja, pero en el síndrome del cromosoma X frágil la penetrancia
es alta. El síndrome del cromosoma X frágil "genera autismo" afecta a
todos los niños que portan el cromosoma afectado, pero en las niñas
heterocigotas que deberían ser portadoras silenciosas existe un alto nivel de
penetrancia debido a la inactivación preferente del cromosoma X que porta el
alelo normal. La otra alternativa es que el alelo no funcional esté asociado de
forma preferente al cromosoma que es inactivado, en estos casos tenemos una
inactivación de la enfermedad, fenómeno que disminuye la penetrancia de la
enfermedad. Algunos síndromes autoinmunes, la disqueratosis congénita siguen
este patrón de herencia.
Los patrones dominante y recesivo en la herencia vinculada
al cromosoma X se distinguen en base al fenotipo de las hembras heterocigotas.
Si el gen que se está rastreando no es afectado por la inactivación del
cromosoma X la herencia de las mujeres es de forma mendeliana clásica. El
problema ocurre con los genes afectados por la inactivación, ya que las hembras
heterocigotas enfrentan un efecto de aleatoriedad del 50% de presentar o no el
fenotipo dominante aun cuando portan el alelo dominante. En términos de
patologías o desordenes genéticos: Cerca del 40% se clasifican como recesivos
debido a que presentan una penetrancia mínima con respecto al alelo dominante.
El 30% se pueden considerar dominantes ya que su penetrancia es mayor al 85%
que el alelo está presente. El otro 30% posee una penetrancia variable entre el
15-85% cuando se encuentran en estado heterocigoto.
Impronta
genética
En contraste con la herencia ligada a los cromosomas
sexuales, los patrones de expresividad genética pueden ser afectados por el
sexo de un individuo incluso cuando los loci de estos genes son autosómicos.
Múltiples ejemplos, en diferentes organismos muestran que el sexo de los
individuos juega un rol semejante al de la epistasis (interferencia,
sobrelapamiento o acoplamiento) lo cual provoca que los machos y las hembras
presenten fenotipos diferenciados. Se pueden dar casos fuertes en los que
existen fenotipos restringidos para cada sexo, o casos suaves en los que existe
una frecuencia mayor de un fenotipo para un sexo, pero con presencia de
individuos excepcionales.
Un solo gen controla la forma de las plumas de la cola en Gallus,
existen 3 varianes, el homocigoto dominante HH, el heterocigoto Hh y el
homocigoto hh. Todas las hembras sin importar el genotipo tienen colas cortas,
pero los machos homocigotos recesivos tienen colas largas. En ambos casos los loci
de los genes involucrados son autosómicos, es decir se encuentran localizados
en posiciones que no tienen nada que ver con los cromosomas sexuales, pero su
expresividad depende de la adecuada señalización celular gracias a las hormonas
sexuales. Ejemplos de estos caracteres son la cola de los gallos, la calvicie
en los hombres, la forma de los cuernos en algunos corderos.
Matemáticamente provoca la apariencia como si el cromosoma y
tuviera genes en el cromosoma X homólogos, pero eso solo es una ilusión, lo que
sucede es que el cromosoma y posee factores de transcripción que activan
parejas de cromosomas somáticos que si tienen loci homólogos. Estos loci no se
activan sin la presencia del cromosoma y, creando una restricción de fenotipo
diferenciado para machos. La impronta constituye un ejemplo de un proceso más
general llamado epistasis.


No hay comentarios:
Publicar un comentario